|
管理员

|
【为创造伟力作出贡献】
西安交大科研人员在智能响应型多模态肿瘤治疗领域取得重要进展 化疗是目前治疗癌症的主要手段之一,但是传统的化疗方法常常“敌我不分”,在杀伤癌症细胞的同时也杀伤了正常细胞,造成其治疗效率低下且毒副作用明显。因此,使用具有肿瘤靶向性和环境响应性的纳米药物载体以改变传统化疗的给药方式,降低抗癌药物对正常组织的毒性,并结合多种新颖的治疗手段(如光热疗法、催化医学等)进行协同治疗,进而提高治疗效果,已经成为当前研究的一大热点。然而目前的光热治疗和催化医学依然缺乏选择性,如何降低治疗过程对体系周围健康组织的损害依然是多模式治疗有待解决的难题。 
针对上述问题,西安交通大学化工学院陈鑫研究员课题组将响应性药物控释、选择性光热治疗与催化医学相结合,构筑了新型多模式肿瘤治疗微纳平台,成功实现了对多种肿瘤的精准治疗。在前期工作基础之上,本研究进一步提出集成肿瘤微环境响应型药物控释、肿瘤微环境触发的光热治疗和肿瘤微环境敏感型的催化反应,进而构筑多模式协同治疗的智能平台来精准治疗肿瘤的新思路。为了实现该设想,研究团队设计并合成一种半胱氨酸修饰的金纳米粒子以及氨基功能化的介孔二氧化硅纳米粒子,通过引入亚铁离子使金纳米粒子通过配位键键合到二氧化硅表面,实现对介孔内药物的封堵。该纳米载体在肿瘤细胞内低pH下诱导携带亚铁离子的金纳米粒子从载体表面脱落释放出装载药物,同时脱落的金纳米粒子将进行原位自组装团聚从而能够用于光热治疗。此外,体系内的亚铁离子将催化细胞质内存在大量过氧化氢产生羟基自由基,从而达到光疗-化疗-催化协同治疗的目的。 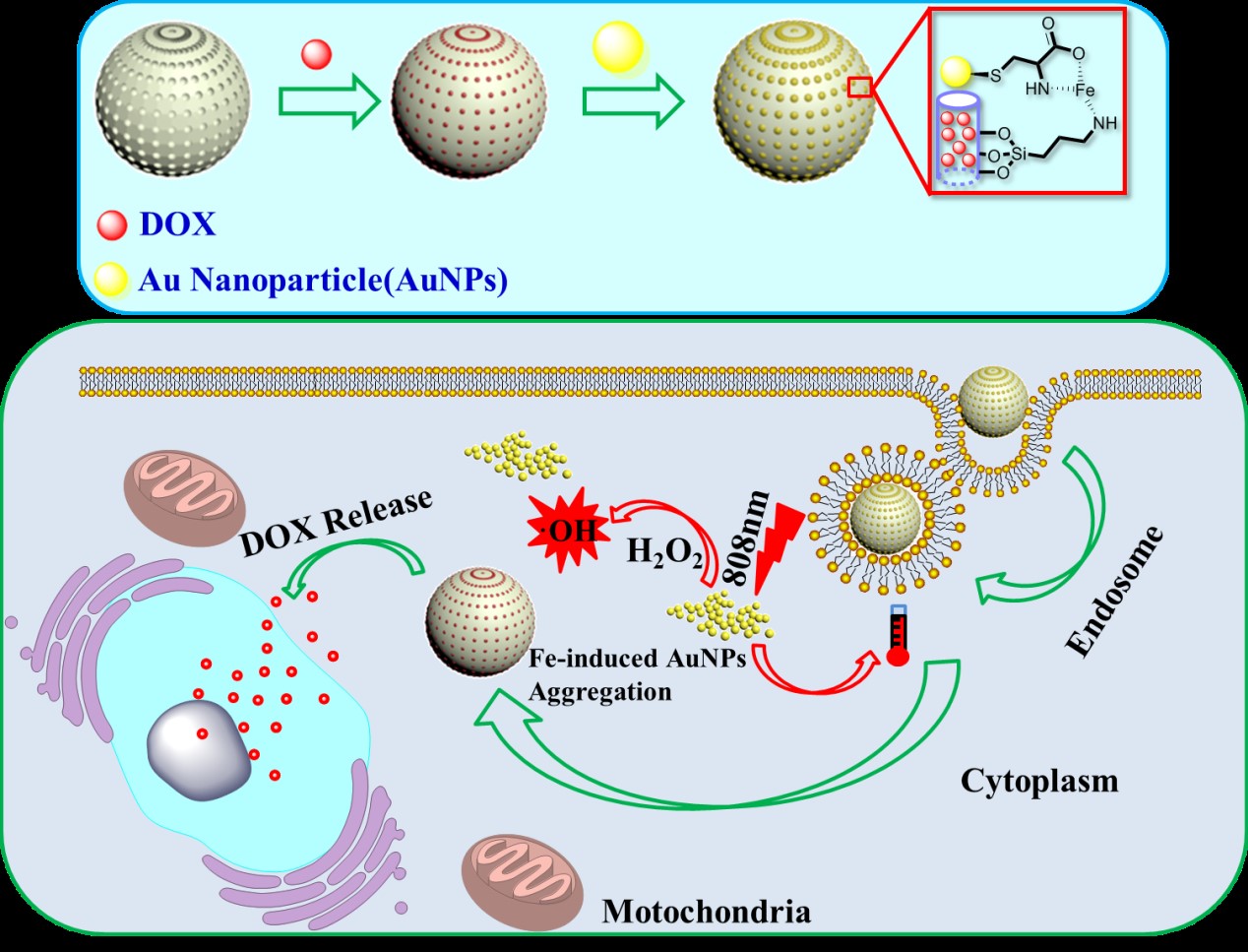 肿瘤微环境响应性多模式治疗体系的构筑及治疗示意图 相关研究成果以“Core-Satellite Mesoporous Silica–Gold Nanotheranostics for Biological Stimuli Triggered Multimodal Cancer Therapy”为题发表在化学和材料领域权威期刊 Advanced Functional Materials(影响因子:12.124)上(Adv. Funct. Mater., 2018, 1801961,DOI:10.1002/adfm.201801961)。该论文的第一作者为2016级博士生靳荣华,通讯作者为陈鑫研究员,西安交通大学化工学院为论文的第一及唯一通讯单位。 该研究工作得到了国家自然科学基金、陕西省自然科学基金、西安交通大学“青年拔尖人才支持计划”、陕西省百人计划、陕西省留学人员择优资助计划、军事口腔医学国家重点实验室开放课题等项目的大力支持。 【延伸阅读】 陈鑫,西安交通大学化工学院高分子化工研究所所长,陕西省“百人计划”学者,西安交通大学“青年拔尖人才”,西安交通大学“十大学术新人”。主要从事仿生高分子复合材料的构筑、功能化和性能调控等领域的研究,致力于相关材料在组织再生(智能支架材料)、疾病治疗(药物/基因载体)、疾病早期检测(纳米传感器)等医学工程方面的应用。先后主持国家自然科学基金、省部级科研项目、国家重点实验室开放课题、企业横向项目和多种人才支持项目等。作为第一/通讯作者在ACS Nano, Advanced Functional Materials等国际知名学术期刊上发表科研论文40余篇,受美国科学出版社及ELSEVIER出版社邀请撰写学术专著2章,申请/授权国家发明专利5项。目前担任多个国内外学术期刊编委及客座编辑。
文字:化工学院 编辑:程洪莉 Core–Satellite Mesoporous Silica–Gold Nanotheranostics for Biological Stimuli Triggered Multimodal Cancer Therapy Ronghua Jin Zhongning Liu Yongkang Bai Yongsheng Zhou J. Justin Gooding Xin Chen First published: 06 June 2018 https://doi.org/10.1002/adfm.201801961 Abstract A core–satellite nanotheranostic agent with pH‐dependent photothermal properties, pH‐triggered drug release, and H2O2‐induced catalytic generation of radical medicine is fabricated to give a selective and effective tumor medicine with three modes of action. The nanocomplex (core–satellite mesoporous silica–gold nanocomposite) consists of amino‐group‐functionalized mesoporous silica nanoparticles (MSN‐NH2) linked to L‐cysteine‐derivatized gold nanoparticles (AuNPs‐Cys) with bridging ferrous iron (Fe2+) ions. The AuNPs‐Cys serve as both removable caps that control drug release (doxorubicin) and stimuli‐responsive agents for selective photothermal therapy. Drug release and photothermal therapy are initiated by the cleavage of Fe2+ coordination bonds at low pH and the spontaneous aggregation of the dissociated AuNPs‐Cys. In addition, the Fe2+ is able to catalyze the decomposition of hydrogen peroxide abundant in cancer cells by a Fenton‐like reaction to generate high‐concentration hydroxyl radicals (·OH), which then causes cell damage. This system requires two tumor microenvironment conditions (low pH and considerable amounts of H2O2) to trigger the three therapeutic actions. In vivo data from mouse models show that a tumor can be completely inhibited after two weeks of treatment with the combined chemo‐photothermal method; the data directly demonstrate the efficiency of the MSN–Fe–AuNPs for tumor therapy. 来源:交大新闻网 日期 2018-06-12 16:29 
西安交大科研人员在智能响应型多模态肿瘤治疗领域取得重要进展 http://news.xjtu.edu.cn/info/1004/94687.htm |

 一键同布到我集网·各家微博
一键同布到我集网·各家微博